光固化生物3D列印技術(如:數字光處理,DLP)可精確控制細胞和生物材料在空間中的分佈,以此構建複雜幾何結構,被廣泛應用於組織工程、藥物篩選、外科植入物等生物醫學研究領域。然而,在DLP列印過程中,光在固液兩相界面會產生物理散射,細胞的混入會加劇此種散射效應,導致水凝膠在非目標區域固化,降低了列印精度,使眾多生物性能優異且具有小尺度特徵(如血管網絡和薄壁結構等)的複雜結構難以成型,限制了DLP列印技術在生物醫學領域的應用。
針對這一挑戰,湖南大學機械與運載工程學院韓曉筱教授等提出了一種光吸收與自由基反應協同作用的光散射抑制新機制,並基於此機制開發了一種新型光抑製劑(Curcumin-Na,Cur-Na),降低了載細胞水凝膠光固化列印過程中的光散射效應,將列印精度提高到1.2-2.1像素點,幾何誤差低於5%,成功製造了各種具有多尺度通道和薄壁網絡結構的生物活性功能支架。此外,該方法具有較寬的列印參數窗口,極大地縮短了參數優化過程。相關研究成果以題為”Photoinhibition via simultaneously photoabsorption and free-radical reaction for high-fidelity light-based bioprinting”的文章發表在《Nature Communications》(SCI一區,Top期刊,IF=17.69)。湖南大學博士研究生賀寧為第一作者,湖南大學機械與運載工程學院韓曉筱教授和陳鋒副教授為協作作者。
提高3D生物列印精度與保真度的新型光抑製劑技術開發
水凝膠生物墨水中傳統的光吸收劑能夠吸收過量的光能量,防止列印層厚過厚,從而在一定程度上提高垂直方向上的列印精度。然而,傳統的光吸收劑難以解決由光散射引起的水平方向上過固化的問題。因此,該研究提出了光吸收與自由基反應協同作用的光抑制機制:保留傳統光吸收劑功能的同時並能“搶奪”水平方向上散射光激發的自由基,抑制散射區域的自由基與水凝膠發生聚合反應,防止非目標區域的固化,從而提高水平方向上的列印精度和保真度。基於此機制,該團隊首先成功開發了一種新型光抑製劑(Cur-Na)(如圖1),其具有良好水溶性和生物相容性。接著,該團隊製備了含不同光抑製劑的PEG-GelMA生物墨水,通過研究生物墨水的物化性質評價了其可列印性和機械性能(如圖2)。然後通過理論和實驗研究聚合過程,揭示了Cur-Na減輕散射效應的機制(如圖3):Cur-Na的吸收峰位於425nm附近,非常接近光源波長,可以作為典型的光吸收劑降低光穿透深度。同時,Cur-Na 可以通過更高的反應速率競爭性地搶奪自由基來阻止水凝膠單體聚合形成固化水凝膠。再者,Cur-Na 的反應產物為液體,避免了非目標區域的固化。由於Cur-Na 的高反應性速率,固定濃度的Cur-Na 可以在很寬的光強度範圍內抑制散射效應,避免在列印不同結構的時,列印參數再次優化,提高列印效率。文章中,圖4和圖5定量研究了加入Cur-Na後的生物墨水的列印分辨率和圖案保真度,以驗證Cur-Na在解決光散射效應方面的有效性。之後,團隊將添加了Cur-Na的生物墨水應用到microArch® S140光固化列印機中,成功地製造了各種複雜結構體(仿生支架,可灌注血管網絡,極小三週期曲面等),證明了該光抑製劑在製造具有小尺度特徵的功能性載細胞三維支架方面的卓。越能力(如圖6)。圖7進一步證明了此生物墨水在組織工程中的適用性。
Cur-Na 的表徵
為了獲得水溶性反應性添加劑,我們利用碳酸氫鈉對薑黃素進行化學修飾,合成了Cur-Na,其中薑黃素分子酚羥基的H +被Na +取代(圖 1a中的紅色橢圓)。同時,薑黃素中的羰基鍵由於甲醇中的羥基而發生酮烯醇互變異構,形成新的C=C雙鍵(圖 1a中的藍色橢圓)。這種修飾經由質子核磁共振波譜(1 H-NMR)得到證實。如圖1b所示 ,薑黃素中添加鈉後,酚羥基(δ =9.65ppm)的特徵共振消失,顯示H +被取代。 C=C雙鍵的形成由烯烴訊號的變化(δ = 5.93 ppm)證明,其中出現了代表三取代烯烴的新訊號峰(圖 1b)。1 H-NMR 和13 C-NMR的全譜可參考補充圖 1和圖 2。 Na的存在由23 Na-NMR譜決定(參見補充圖 3)。透過高解析度質譜(HRMS)測得的分子量為434,與結構式相同(參見補充圖 4和補充表 1)。合成 Cur-Na 是一種多功能添加劑,可加入生物墨水中以提高列印品質。為了驗證其對基於光的 3D 生物列印的適用性,最初透過實驗評估了光吸光度和水溶性。如吸收光譜(補充圖 5)所示,Cur-Na 由於在405 nm 附近的吸收峰(~425 nm)而表現出優異的光衰減能力,這是基於光的3D 生物列印中常用的波長,因為其有害性較低。因此,Cur-Na可用作光吸收劑,有效防止過固化層,提高垂直列印解析度。此外,Cur-Na的水溶性高達51 mg mL -1,使其非常適合配製含水生物墨水。低濃度生物材料(例如 PEGDA 和 GelMA)和高含水量的溶液由於具有高生物性能和良好的流動性,有利於生物列印。當 Cur-Na 單體溶解在這種稀釋的生物墨水中時,反應性官能基(烯烴的三個 C=C 雙鍵)可以參與鏈增長反應,為基本聚合過程提供額外的可控性。這種機制對於提高列印品質具有重要意義,這將在光抑制機制部分詳細解釋。
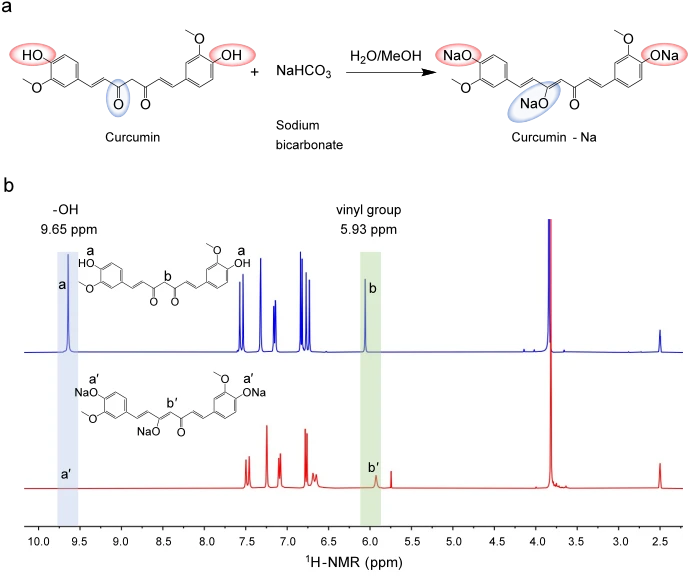
生物墨水的特徵
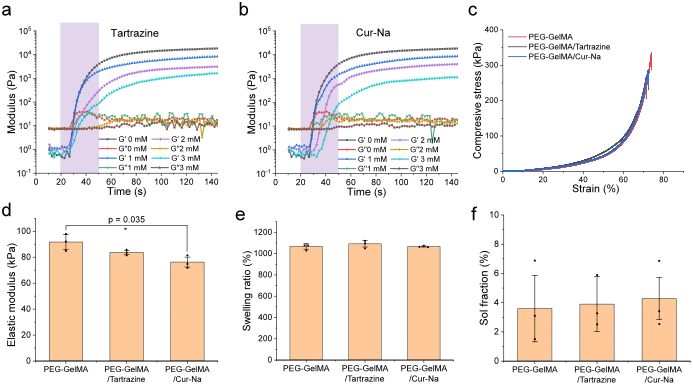
開發了三種用於流變學研究的預水凝膠製劑,包括 PEG-GelMA/LAP(作為對照)、PEG-GelMA/LAP/檸檬黃和 PEG-GelMA/LAP/Cur-Na。為了進行比較,採用光吸收劑檸檬黃,因為它具有生物相容性、毒性低且吸收峰值接近列印機的光波長(405 nm)。 PEGDA 和 GelMA 都是廣泛用於 DLP 列印的典型水凝膠。它們的交聯過程受自由基鏈聚合控制,因此它們是評估光抑制方法性能的合適候選者。使用PEGDA 和 GelMA 的組合是因為它保留了適當的機械穩定性和細胞黏附,並且已被證明在用作支架材料時有利於功能。根據為生物墨水建立的工作曲線(圖 6),層厚度、光強度和曝光時間分別確定為100 μm、13 mW cm -2和10 s。這樣一組參數確保固化深度略大於增強兩個相鄰層的黏合所需的層厚度,同時實現列印速度和垂直解析度之間的期望平衡。
然後對生物墨水進行光流變表徵,以評估其列印適性並了解 Cur-Na 如何影響聚合的凝膠動力學。添加不同濃度檸檬黃和Cur-Na的生物墨水的儲能模量( G’反映材料的剛度)和損耗模量(G”反映材料的黏度)隨時間的演變如圖 2a、b所示,其中G”和G’通常稱為凝膠點。光照射後,儲能模量在早期迅速上升,隨後當曝光時間增加時發生適度的變化並最終穩定。如圖2a、b中的 G’值所示,增加兩種添加劑的濃度會導致交聯密度呈現劑量依賴性降低,這意味著過量的光抑制添加劑會降低聚合水凝膠的機械性質。格里戈里安等人。證明添加不同量的檸檬黃的PEGDA最終透過將暴露時間延長到反應終止點以上而達到等效的儲能模量,使得機械性能與添加劑的濃度無關。然而,延長的照射時間會延長細胞暴露於自由基的時間,自由基會損害細胞膜和蛋白質 41、42,進而影響細胞活力。凝膠時間定義為暴露於凝膠點的開始時間(圖 2a、b中的陰影區域),當檸檬黃濃度增加到3 mM 時,凝膠時間略有延長(從10.4 到13.2 s),同時增加了一倍對於 Cur-Na(從 10.4 到 21.5 s),表明交聯速率取決於添加劑的濃度,並且與檸檬黃相比,Cur-Na 具有更高的光抑制效率。如此高的效率對於基於光的生物列印至關重要,因為低濃度的Cur-Na足以抑制散射效應,同時不會顯著降低剛度(見圖 2c,d)。三種生物墨水之間的溶脹比和溶膠分數的差異也可以忽略不計,並且觀察到較低的溶膠分數值(<6%),這表明Cur-Na 和檸檬黃對溶脹和交聯動力學的影響有限(圖 2e、f)。根據上述分析,選擇檸檬黃和Cur-Na的濃度均為1 mM進行進一步研究,以確保列印產品的快速列印速度和適當的機械性能。
光抑制機制
DLP 中單一微鏡投射的光束通常是高斯光束,其強度從光束中心到周圍遵循高斯定律遞減。當入射高斯光束穿透生物墨水時,它會遇到比爾-朗伯定律支配的指數吸收。結果,形成具有高斯分佈的光強度,導致圖 3a中描繪的拋物線狀固化區域。固化深度 ( C d ) 決定垂直分辨率,並且應限制在所需的厚度以產生高分辨率的結構。光散射可以透過加寬固化寬度 ( C w )來改變固化區域的形狀,從而顯著降低橫向解析度並導致圖案精度較差。在細胞存在的情況下,散射效應進一步放大(見圖 3a)。
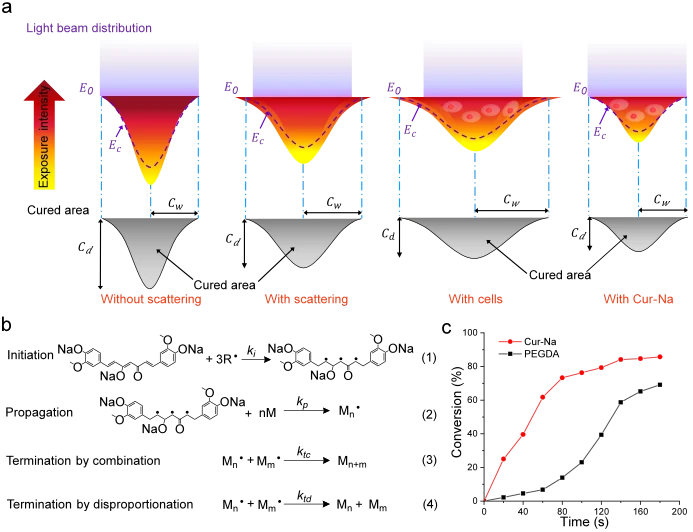
Cur-Na 當溶解在生物墨水中時,可以透過同時發生的光吸收和自由基反應幹擾基本聚合過程,從而減少光穿透並抑制光散射。如前所述,Cur-Na 在光源波長(本例中為 405 nm)附近具有吸收峰(~425 nm),因此可以作為典型的光吸收劑來減少光穿透深度。除此之外,Cur-Na還可以透過消耗散射光產生的自由基來有效抑制散射效應。從機理上講,Cur-Na(烯烴的三個C=C 雙鍵)的反應性官能基能夠透過典型的鏈增長聚合機制與自由基反應,該機制由三個不同的步驟控制,包括引發、增長和終止(見圖 )1因此,Cur-Na 和水凝膠(例如 PEGDA 和 GelMA)可以在光引發劑和光存在下同時與自由基反應。一個問題是 Cur-Na 是否更有效地消耗自由基,使水凝膠單體缺乏自由基,從而在分散的區域形成光交聯水凝膠。為了提供定量證明,在相同的聚合條件下測量了 Cur-Na 和 PEGDA 的 C=C 雙鍵轉換分數與時間的關係,反映了聚合速率。如圖3c所示 ,Cur-Na的聚合從開始到80秒以極高的速率(線的斜率)快速發生,並在轉換的C=C雙鍵達到~80%時減速。相較之下,PEGDA的聚合在早期階段進行得較慢,隨後逐漸加速。 Cur-Na 的轉化分數持續大於 PEGDA 的轉化分數(約 2-7 倍),這表明 Cur-Na 具有更高的反應活性,並且更大部分的自由基被 Cur-Na 消耗。因此,由於自由基不足,PEGDA 無法在分散區域產生固化水凝膠。 Cur-Na 的高反應性主要歸因於 1) 每個 Cur-Na 分子具有三個反應性 C=C 雙鍵,而 PEGDA 則為兩個 (見圖 3b1, 2 ) Cur-Na 的分子量(Mn )與PGEDA(Mn = 6000 Da)相比,Mn = 436 Da)要低得多,這可以增強鏈的遷移率,從而顯著加速傳播過程(圖 3b2)。增長通常主導整個聚合速率,因為在此步驟中消耗了所有單體(除一種)43。另一個擔憂是,與 PEGDA 類似,Cur-Na 的聚合反應是否會在分散區域形成交聯固化,從而降低列印解析度。我們以實驗證實,即使使用高濃度的 Cur-Na(~5 wt%),由於分子量低導致交聯密度不足,最終聚合的 Cur-Na 也無法產生固化聚合物。相反,聚合後觀察到液態,並且最終的Cur-Na聚合產物可以在列印後被洗掉。
一方面,一旦分散區域產生自由基,Cur-Na可以透過以明顯更高的速率競爭性消耗自由基來阻止水凝膠單體聚合形成固化水凝膠。另一方面,與典型的水凝膠不同,Cur-Na 的反應產物是液體,從而避免產生不必要的凝固。此外,由於其高反應性,固定濃度的Cur-Na可以抑制較寬光強範圍內的散射效應,從而避免了為製造不同結構而重新優化列印參數。這種簡便的機制可以有效提高列印解析度和圖案保真度。
列印解析度和保真度
為了證明 Cur-Na 提高列印分辨率和圖案保真度的能力,我們首先定量評估了列印物體的橫向分辨率,並比較了先前開發的三組生物墨水之間的分辨率差異。輪輻狀圖案(見圖 4a),原由You等人提出。透過計算未分辨分數來量化列印分辨率,未分辨分數定義為未分辨直徑(在圖4a中標記為紅色虛線圓圈)與外徑之間的比率 。鑑於 DLP 列印本質上是一種逐層聚合材料的過程,因此在多層製造之前研究單層的分辨率是合乎邏輯的。由此製備了單層100μm的輻條狀結構。採用不同的光強度來測試解析度對光能量劑量的敏感度,這有助於確定列印參數的容差視窗以及列印不同結構是否需要重新最佳化。
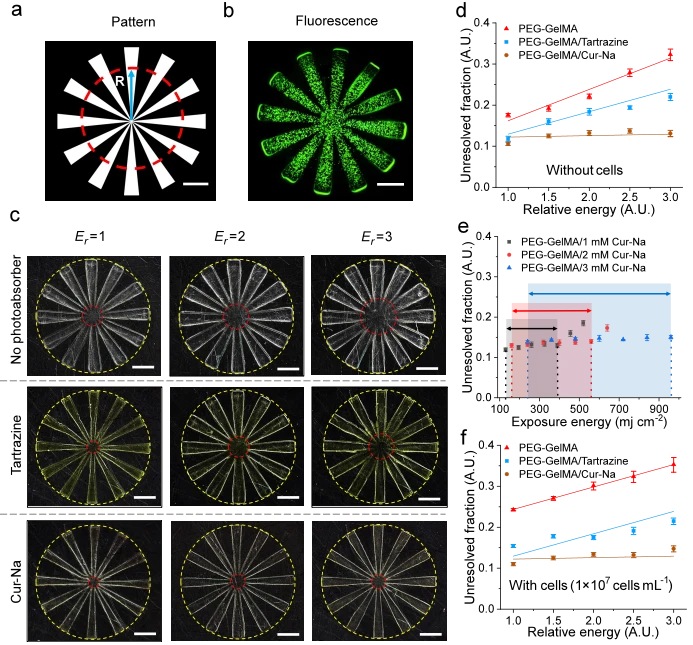
圖 4c顯示了不含細胞的列印結構的顯微照片,顯示了未解析區域(紅色虛線圓圈)作為純PEG-GelMA 生物墨水以及添加了檸檬黃和Cur-Na 的生物墨水的相對曝光強度的函數。可以觀察到,純PEG-GelMA生物墨水錶現出最大的未解決部分,且列印的輻條與設計的輻條之間的尺寸差異(圖 4a)明顯較大,這主要是由於散射導致的過度固化。這強調了這樣一個事實,如果不摻雜光抑制添加劑,甚至無法製造簡單的結構。同樣明顯的是,當光能量增加時,未分辨區域會擴大。當生物墨水中添加 1 mM 檸檬黃時,儘管所有能量劑量的未解析部分都降低了,但曝光強度的分辨率敏感性仍然很明顯。在 Cur-Na 的情況下,解析度顯著提高,如圖4c下圖未分辨圓圈縮小所示 。儘管在圖中視覺上很明顯,但對光強度的敏感度很小。為了量化分辨率差異,未分辨分數和相對能量之間的關係繪製在圖 4d中。可以看出,純 PEG-GelMA 生物墨水的分辨率高度依賴能量劑量,當曝光強度增加三倍時,未解析度的部分從約 17% 放大到約 33%。檸檬黃也觀察到類似的趨勢,當E r = 1 和E r = 3 時,數值分別降低約 12% 和約 21%。與檸檬黃不同,Cur-Na 的未溶解部分保持在幾乎恆定的值,與曝光強度無關,低至約12%,這表明固定濃度的Cur-Na 可以處理不同強度的散射,同時保持更高的列印效果解決。圖 4e描繪了列印窗口,該窗口表徵了保持列印解析度的曝光能量範圍,作為選擇 Cur-Na 濃度的定量指南。對於其他光吸收劑(例如,麗春紅4 R),觀察到與檸檬黃類似的趨勢,因為它們的吸收峰相當,檸檬黃和麗春紅4R 的吸光度峰值分別為約405 nm 和約500 nm(參見補充圖 8)。
當細胞被封裝時(參見圖4b中的螢光染色影像 ),純PEG-GelMA生物墨水的散射效果更加明顯,進一步增加了未解析的區域,從而降低了列印解析度(圖 4f和補充圖 9))。對於檸檬黃,基本上控制散射程度的曝光強度增加時,由於散射增強而導致解析度降低(圖 4f)。可能需要更高濃度的檸檬黃來補償過度固化的增加。然而,這是以犧牲結構的剛度和列印時間為代價的,因為在列印分辨率、列印效率和機械性能之間存在著由光吸收劑的濃度調節的權衡。單純增加檸檬黃或麗春紅4R的用量並不能提升列印品質(參見補充圖 8c、d)。比較用 Cur-Na 印製的無細胞(圖 4d)和載細胞(圖 4f)結構,由於所描述的 Cur-Na 的散射抑制機制,細胞增強散射對列印解析度的影響可以忽略不計之前。上述結果表明,與純光吸收方法相比,Cur-Na可以更好地提高列印分辨率,並且固定的低濃度Cur-Na足以抑制各種強度的散射效應,從而簡化了操作過程。對於純粹基於光吸收的方法,需要調整光吸收劑(例如檸檬黃)的濃度以匹配獨特的散射特性,以實現更好的列印解析度。然而,散射特性隨著光強度、生物墨水配方、暴露時間、結構形狀和細胞密度的變化而顯著變化。
由於光散射問題和水凝膠的稀釋性質(膨脹和低黏度),使列印解析度與列印機的光學解析度相符是 DLP 列印面臨的最大挑戰之一。研究了列印解析度對水凝膠和各種光抑制劑濃度的敏感性,以了解光散射和膨脹如何影響列印解析度(請參閱補充圖 10)。本研究中使用的PEG-GelMA/Cur-Na 水凝膠表現出約2.1 像素的列印分辨率,而當PEGDA 的濃度增加至30% 時,可實現接近列印機光學分辨率的分辨率(約1.2 像素)。因此,一旦列印油墨的膨脹被完全限制,使用本研究中提出的方法就可以實現 DLP 列印機的全部列印能力(1 像素)。對於 30% PEGDA 水凝膠,儘管進行了廣泛的參數調整,但當用標準光吸收劑取代 Cur-Na 時,解析度從約 1.2 像素下降到約 2.7 像素。這種變化主要是由於散射效應所致,因為溶脹率幾乎相同,顯示Cur-Na可以更有效抑制光散射。
然後我們研究了 Cur-Na 如何抑制多層製造過程中的散射效應,從而提高 3D 結構的列印品質。生物製造的中空結構對於生物醫學應用特別重要,因為它們對於引導組織再生、形成血管網絡以及適應細胞附著和生長至關重要。具有各種直徑(300、500 和 700 μm)的開放通道的圓柱形樣品採用 DLP 列印,高度範圍為 0.2 mm 至 3 mm(見圖 5a)。在列印過程中,由於主要由散射引起的過度固化,可能會發生通道堵塞(見圖 5b和補充圖 11)。為了解釋這種影響,採用解析分數(定義為中空截面與通道總長度之間的比率)來表徵列印效能。值為 1 表示通道中空且可灌注,而 0 表示完全阻塞。圖 5c-e分別說明了直徑 300、500 和 700 μm 時,解析分數隨圓柱體高度的變化。所有通道均使用添加了 Cur-Na 的生物墨水成功製造,展示了列印 3D 通道結構的卓越能力。對於檸檬黃,當直徑變小時或高度增加時,列印性能逐漸下降,表現出對列印層數的強烈依賴性。例如,當圓柱體高度從 600 μm 增加到 3000 μm 時,解析度分數從 1 降低到~0.2(見圖 5e)。正如預期的那樣,當使用純 PEG-GelMA 生物墨水時,性能進一步減弱。上述結果揭示了一個重要的影響,即光散射可以在連續列印過程中疊加,導致列印大型結構時不期望的凝固顯著增強。我們觀察到,隨著列印過程的進行,位於通道中的生物墨水慢慢變得更稠密。一個可能的原因是,由於缺乏再循環,被捕獲的生物墨水沒有及時更新,導致交聯密度增加37。此外,與最初透明的液體生物墨水19相比,聚合固體層具有高度散射性,這可以進一步促進散射的累積。
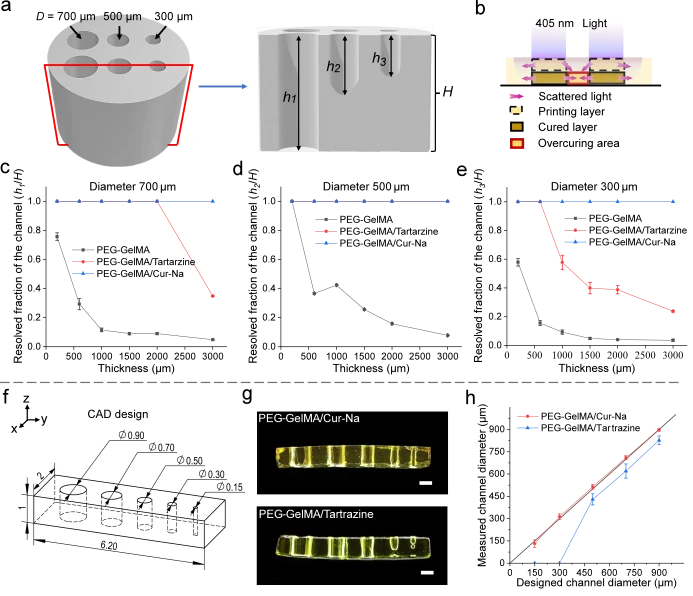
為了證明 Cur-Na 的高保真能力,透過比較設計和 DLP 列印之間的幾何差異來進行列印誤差分析。依照先前提出的方法,設計了具有不同通道直徑(900、700、500、300和150μm)的多通道結構來評估添加檸檬黃和Cur-Na的生物墨水的列印誤差(見圖1 )。如圖5g所示 ,使用Cur-Na生物墨水令人滿意地製造了所有開放通道而沒有堵塞,實現了直徑150μm的最小通道。然而,在用檸檬黃摻雜生物墨水的情況下,由於散射引起的不期望的凝固,150和300μm通道被阻塞(參見圖 5g)。圖 5h比較了設計直徑和測量直徑,其中假設堵塞通道的直徑為零。可以看出,使用Cur-Na列印的頻道尺寸與設計吻合得很好,平均誤差小於~5%,列印精度較高。對於檸檬黃,儘管我們仔細優化了檸檬黃的濃度,但由於過度固化,測量的直徑比設計的直徑縮小了約 50 μm。胡等人。研究了最常用光吸收劑的濃度對 DLP 列印精度的影響。他們證明,如果通道直徑太小,固定濃度的光吸收劑無法有效抑制散射效應,導致過度固化和堵塞。相反,當直徑增加時,光線被過度阻擋,導致列印直徑大於設計直徑。由於散射強度的動態變化,存在著從過度固化到聚合不足的轉變。因此,光吸收劑的濃度應與結構的散射特性精確匹配,以最大限度地減少列印錯誤,這給實際應用帶來了重大挑戰。與光吸收劑不同,Cur-Na 能夠自適應散射特性的動態變化,從而無需重新優化列印參數即可製造各種高保真 3D 結構,如下一節將進一步強調。
列印 3D 結構的效能
為了進一步證明Cur-Na對複雜3D結構的可列印性,使用PEG-GelMA/Cur-Na生物墨水製造了複雜的支架,包括脊髓支架、血管和陀螺支架(圖 6)。在先前的研究中,具有平行排列通道的神經支架通常用於仿生活神經結構,用於脊髓損傷修復。使用 Cur-Na 生物墨水成功製造了新設計的脊髓支架,顯示出不規則的通道和薄壁網絡,可以更好地模擬脊髓的內部結構(圖 6a和補充圖 12a)。薄壁網絡的厚度範圍約為 80 至 100 μm,這對於代謝物的有效交換和氧氣滲透至關重要。尺寸約 150-200 μm 的血管網絡對於為長期細胞活動建立足夠的血管化是必需的;然而,對於血管網絡接近毛細血管34、48尺寸的工程組織來說,這仍然是一個相當大的挑戰。基於我們先前設計的用於皮膚組織再生的 3D 血管模型,使用相同的生物墨水配方製造了具有多個分支和可灌注通道(800–200 μm)的血管網絡(圖 6b),展示了生成血管的高性能具有巨大的長度尺度。血管壁(~100 μm)保存完好,這與先前的 DLP 列印的水凝膠血管網絡不同,其中通道嵌入大量水凝膠內。透過注射有色染料溶液確認血管網絡的灌注(圖 6b和補充影片 1)。由四重連接點製成的螺旋支架因其獨特的拓撲特徵(例如曲面、高孔隙率和互連性)而在組織支架中顯示出前景,可為細胞活動產生最佳的營養和廢物擴散。然而,建築的豐富性導致了難以製造的薄壁結構。 3D 列印螺旋支架的大多數應用集中在硬組織修復上,並且列印材料(例如聚(ε-己內酯)和羥基磷灰石)通常表現出高剛度。然而,用水凝膠設計的功能性細胞化陀螺支架卻很少被報導。胡等人。 DLP 使用基於光吸收的方法列印了厘米級的充滿細胞的陀螺儀支架。然而,細胞活力和功能並未得到證實。在這項研究中,使用Cur-Na生物墨水成功製造了螺旋支架,從而形成了尺寸為150μm的有序孔(圖 6c)。為了證明細胞功能的性能,也成功製造了封裝有對光散射敏感的HepG2細胞(1×10 7 mL -1 )的陀螺儀支架。培養14天後觀察到高細胞增生(圖 6d )。重要的是,在第7天觀察到球體形成,且白蛋白的蛋白質表現隨後迅速增加(參見補充圖 13),顯示肝功能增強。用水凝膠設計的細胞化螺旋支架為組織工程提供了許多新的應用。

為了證明 Cur-Na 用於其他水凝膠的可行性,使用 Sil-MA 7生物墨水製造了脊髓支架,該生物墨水的可列印視窗濃度為 15-30%。 Sil-MA生物墨水是不透明的(強光散射),列印的部件通常具有較低的壓縮性能,因此更適合探索Cur-Na的性能邊界。儘管 Kim 等人使用了濃度為 30% 的 Sil-MA 與標準光吸收劑混合,但本研究中採用了列印窗口的最低值 (15%)。展示其對 3D 複雜結構進行圖案化的能力。令人驚訝的是,使用 Cur-Na 成功製造了支架,精確地再現了設計的精細尺度特徵(參見補充圖 12b)。然而,使用標準光吸收劑時,列印結果並不理想,主要是由於強烈的光散射,顯示出扭曲的薄壁網絡和阻塞的通道。值得注意的是,列印的支架表現出較低的楊氏模量(補充圖 12c、d中所示的8-12 kPa ),比本研究中使用的PEG-GelMA水凝膠軟約9倍,擴大了建構軟組織的潛力,例如肝臟和心臟器官。
細胞相容性
為了評估 Cur-Na 對其他細胞的細胞相容性,對先前開發的三組生物墨水進行了 PC-12 細胞的活/死和 CCK-8 測定(圖 7a,b)。可以觀察到,PEG-GelMA/Cur-Na水凝膠表現出最高的細胞活力,培養14天後細胞增殖增加了約三倍,甚至高於純PEG-GelMA生物墨水。優異的細胞相容性可能歸因於 Cur-Na 源自薑黃素,薑黃素是一種天然酚類抗氧化劑,廣泛用於抗氧化、抗發炎、抗菌等。有趣的是,儘管檸檬黃已被認為具有生物相容性和低毒性,但並未觀察到 PEG-GelMA/檸檬黃水凝膠的細胞增殖。
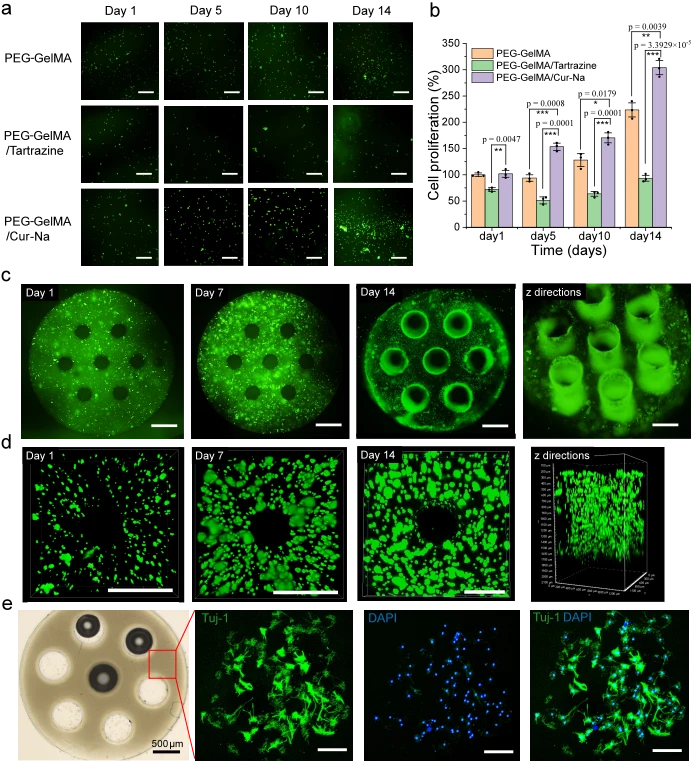
為了進一步證明其對組織工程應用的適用性,我們使用 Cur-Na 生物墨水製造了一個具有多個通道 (200 μm) 的充滿細胞的支架(圖 7c),然後進行體外培養實驗來評估細胞生長行為。列印過程中,每層厚度為100μm,在相對較短的時間內(10秒)列印,可有效防止細胞沉降。可以看出,支架內細胞分佈均勻(圖 7c),這是增強細胞通訊、避免細胞聚集效應的關鍵。直徑 200 μm 的微通道在高濃度細胞 (1–2 × 10 7 mL -1 ) 下形成圖案,進一步突顯了 Cur-Na 在產生充滿細胞的 3D 結構方面的列印性能。培養14天后,細胞沿著通道壁生長良好(圖 7c,d),顯示微通道能夠引導細胞生長,從而促進中樞神經系統再生和血管網絡形成。培養14天後結構保持穩定;然而,與第一天相比,通道的尺寸有所放大。為了驗證Cur-Na和生成的水凝膠是否會影響PC-12細胞的分化行為,透過在含有1 mM Cur-Na的分化培養基中培養PC-12細胞(補充圖 14)並接種來進行兩次分化測試產生的 3D 通道支架表面上的細胞(圖 7e)。培養 7 天后,觀察到分化和神經突形成,證明了細胞功能研究的潛力。
結論
該研究提出了一種光吸收和自由基反應協同作用的光抑制新機制,有效抑制光輔助3D列印中的光散射效應。
基於此機制,開發了一種新的光抑製劑(Cur-Na),具有以下獨。特優勢:(1)顯著提高列印分辨率和保真度:在限制水凝膠的溶脹下,列印精度可接近列印機理論極限(~1像素);(2)具有良好列印參數適應性,極大簡化了列印參數優化過程;(3)在製造具有微尺度通道和薄壁等複雜支架結構上展現出卓。越能力,對於支架內營養物質的運輸和氧氣的滲透具有重要意義;(4)能成功製造對光散射效應尤其敏感的載細胞Gyroid支架,且在歷經14天的培養後,支架內細胞展現出良好的增殖態勢。(5)此方法可應用於其他由自由基鏈生長聚合控制的可光固化墨水中(例如Sil-MA等)。該研究提供的將多尺度特徵直接賦予組織結構的方法,對於更好地模擬天然組織微環境至關重要。研究中確立的策略提高了生物3D列印高保真複雜結構的可列印性和可操作性,從而助力更先進的組織工程和再生醫學應用的實現。
參考文獻:https://doi.org/10.1038/s41467-023-38838-2

業務聯繫
董亦淞 Ted
數位成型部門 技術經理
電話:(07) 331-3520 #607
信箱:Ted@makerwisdom.com
應用工具
__________________
-
microArch® P150-25微米3D列印機
microArch® 微米精密3D列印 -
microArch® S130-2微米3D列印機
microArch® 微米精密3D列印 -
microArch® S140/P140-10微米3D列印機
microArch® 微米精密3D列印 -
microArch® S230-2微米3D列印機
microArch® 微米精密3D列印





